Keemia ajalugu
See artikkel vajab toimetamist. (Juuli 2024) |
Keemia ajalooks võib pidada perioodi vanaajast kuni tänapäevani. Keemia kui omaette teadusharu hakkas välja kujunema alles 17. sajandi keskel.
Teaduslike meetodite arenemisega nähti üha enam erinevusi alkeemia ja keemia vahel, milles mängisid olulist rolli mitmed 17. sajandil tuntuks saanud teadlased. 17. sajandil võttis Robert Boyle kasutusele mitmeid tänapäeva keemias kasutatavaid termineid, näiteks element ja keemiline analüüs. Suureks tõukeks võib pidada ka Antoine Lavoisier'd, kes avaldas massi jäävuse seaduse. 19. sajandisse jääb perioodilisustabeli leiutamine ning selle juures üks silmapaistvamaid keemikuid oli kindlasti Dmitri Mendelejev.
Alkeemiaeelne periood
muudaKiviaeg
muudaÜks esimesi keemilisi reaktsioone, mida inimesed tundma õppisid, oli tuli. Avastati, et tuli põhjustab ühe aine muundumist teiseks, näiteks puidu põlemisel tekib lisaks valgusele ja soojusele ka tuhk, suits ja veeaur. Põlemisel eralduvat soojust kasutati toidu valmistamisel (näiteks vee keetmine).
8000. aasta paiku eKr sai Lähis-Idas alguse revolutsiooniline muudatus: lisaks küttimisele hakati tegelema põllumajandusega. Kariloomade kasvatamine ja maaharimine eeldas inimese paikseks jäämist, mistõttu tekkisid suuremad tsiviliseeritumad piirkonnad. Järgneva paari tuhande aasta jooksil jäi põhiliseks materjaliks kivi, mille töötlemiseks võeti kasutusele uusi tehnikaid. Inimesed oskasid valmistada savist telliseid, savinõusid, lõpuks ka klaasi.
Esimeste metallidena võeti kasutusele looduses vabal kujul esinevad kuld ja vask. Arvatakse, et kividele tehtud tuli põhjustas maakidest metallide sulamist ning jahtumisel moodustusid läikivad metallitükid. Lisaks vasele ja kullale leiti tina, hõbedat ja rauda.
Vaske hakati kasutama tööriistade valmistamiseks, sest kuigi see oli looduses kivist palju haruldasem, oli see sepistatavam. Ajast 3000. aasta paiku eKr on leitud palju vasest valmistatud esemeid.[1]
Pronksiaeg
muudaVase- ja tinamaakide kuumutamisel saadud vedelaid metalle segati omavahel ning saadud sulamit nimetati pronksiks. Aastaks 2000 eKr oli pronks põhiliseks materjaliks relvade ja rüüde valmistamisel, mida kasutati pronksiaja kõige kuulsamas sõjas – Trooja sõjas. Peagi hakati otsima pronksist tugevamat metalli, milleks oli raud, mis tundus üsna haruldase metallina, sest seda leidus vaid meteoriidi tükkides.[1]
Rauaaeg
muudaErinevalt vasest ja tinast oli puhta raua saamine rauamaagist tunduvalt keerulisem. Puhta raua saamiseks oli vaja kõrgemat temperatuuri, milleks kasutati puusütt ning oli vaja tagada pidev õhu juurdepääs. Hetiidid olid esimesed, kes hakkasid kasutama rauda tööriistade valmistamiseks ligikaudu aastal 1200 eKr. Maagi kuumutamisel raua pinnale jääv süsinik tekitas metalli pinnale raua-süsinikukihi, mida hakati nimetama teraseks. Teras hoidis kauem sepistatud vormi ning oli omadustelt tugevam kui pronks.[1]
Klassikaline Vana-Kreeka ja atomism
muudaVana-Kreeka "elemendid"
muudaAlates 600 aastat eKr hakkas Vana-Kreeka filosoofe üha rohkem huvitama ainete erinevad omadused (värv, tihedus, lõhn), ainete erinevad olekud (tahke, vedel, gaasiline) ja reageerimine välismõjudele (vesi, tuli, temperatuur). Klassikalise Vana-Kreeka filosoofid arvasid, et on olemas neli elementi, mis moodustavad kõik ülejäänud ained looduses.
Vana-Kreeka filosoof Thales (640–546 eKr) väitis, et üheks põhielemendiks on vesi. Järeldusele, et taevas ei ole poolkerakujuline vaid terviklik, tuli filosoof Anaximenes Mileetosest ligikaudu 570 eKr. Nad väitsid, et peamiseks elemendiks on õhk, mille kokkusurumisel tekivad vesi ja maa (Vana-Kreeka filosoof Empedocles). Antiik-Kreeka filosoof Herakleitos (u 540–475 eKr) arvas, et selleks elemendiks on hoopis tuli, mis on alati konstante ega muutu teiseks aineks . Paljud Vana-Kreeka, India, Maia ja Antiik-Hiina filosoofid arvasid, et universumis eksisteerib neli peamist elementi: õhk, vesi, maa ja tuli. Vana-Kreeka filosoof Aristoteles (384–322 eKr) iseloomustas elemente nende omaduste põhjal järgmiselt:
- märg ja kuum – õhk
- kuum ja kuiv – tuli
- kuiv ja külm – maa
- külm ja märg – vesi
Aristoteles nimetas lisaks õhule, tulele, maale ja veele ka viienda elemendi – eeter, mis iseloomustas hinge.
Vana-Kreeka klassikalistele elementidele võib paralleelideks tuua gaasi (õhk), vedelikku (vesi), tahkist (maa) ja energiat (tuli).[1]
Vana-Kreeka "aatomid"
muudaFilosoofid olid arvamusel, et kõik ained koosnevad neljast elemendist: õhk, vesi, maa ja tuli. Ioniast pärit filosoof Leucippus arvas u 450 aastat eKr, et kõik ained koosnevad väiksematest osakestest. Democritus oli esimene, kes väitis u 380 eKr, et aine koosneb jagamatutest ja purunematutest aatomitest, mis tuleneb kreekakeelsest sõnast atomos. Tema arvates on kõikide elementide aatomid erineva kuju ja suurusega, mis põhjustas erinevusi elementide omadustes. Paljud filosoofid selle mõtteviisiga kaasa ei läinud, sest puudus teaduslik tõendusmaterjal aatomite eksisteerimisest.
Ligikaudu 300 aastat eKr uskus Epicurus (341–270 eKr), et universum koosneb hävimatutest aatomitest. Seda ideed viis edasi tema õpilane vanarooma poeet ja filosoof Lucretius (u 95–55 eKr), kes kirjutas täispika poeemi "De Rerum Natura" ("Asjade loomus").[1]
Alkeemia
muudaÜldarvamus oli, et khemeia on väga tihedalt seotud religiooniga, seevastu Vana-Joonia filosoofid eraldasid omavahel religiooni ja teaduse. Arvati, et on olemas seitse taevalikku keha, mida nimetati planeetideks (rändajateks), sest nende positsioon tähistaeva taustal oli pidevas liikumises. Lisaks tunti seitset metalli, milleks olid kuld, hõbe, vask, raud, tina, plii ja elavhõbe. Neid metalle vastandati seitsme taevakehaga – kuld on Päike, hõbe on Kuu, elavhõbe on Merkuur, vask on Veenus jne.
Nelja elemendi teooria alusel usuti, et need ained erinevad üksteisest vaid osakeste koostise poolest. Filosoofid ei suutnud seletust leida aga probleemile, kuidas saab üks metall muunduda teiseks, näiteks plii või raua muundumine kullaks. Sellele probleemile proovis seletust tuua Vana-Kreeka filosoof Bolos, kes väitis u 200 aastat eKr, et kulda saadakse vaske ja tsinki kokku sulatades. Saadud sulamit nimetati valgeks vaseks (messing), mis omas kullale omapärast kollast värvust.
Perioodist 200 eKr kuni 550 pKr on üsna vähe teada. Ligikaudu 300 aastat pKr kirjeldas Zosimus oma raamatus, kuidas saada pliiatsetaati, mis on magusa maitsega, kuid ülimürgine ühend. Rooma imperaator Diocletian käskis Zosimuse-aegsed raamatud khemeia'st hävitada, kartes, et hakatakse tootma odavat kulda ning niigi kehv majandus langeb veelgi. Kõigele lisaks said Egiptuse pealinna Alexandria muuseum ja raamatukogu kristlaste rahutuste käigus suuresti kahjustada.[1]
Alkeemia areng Araabias
muudaSõna alkeemia tuleb araabiakeelsest sõnast al-kimiya, millega tähistatakse[küsitav] tänapäeval ajaperioodi 300 aastat eKr kuni 1600 aastat pKr.
Araabia-Pärsia alkeemik Jabir ibn-Hayyan (u aastatel 760–815) sai üheks silmapaistvamaks alkeemikuks, keda kutsutakse keemia isaks. Nimelt pani tema aluse keskaegses alkeemias kasutusel olevale elementide süsteemile, kasutades ka vana-kreeka klassikalisi elemente. Lisaks õhule, veele, tulele ja maale sisaldas elementide süsteem kahte filosoofilist elementi: väävlit, kui põlemisomadustega kivi, ja elavhõbedat, kui metalliliste omadustega vedeliku. Jabir ibn-Hayyan kirjeldas esimest korda ammooniumnitraati, valgevase saamist ning eraldas mitmeid happeid, näiteks äädikhape, sidrunhape, lämmastikhape, hüdrokloriidhape, kuningvesi.[1]
Erinevalt Vana-Kreeka ja Egiptuse alkeemikutest, kelle väited olid allegoorilised, esitas Jabir ibn-Hayyan süstemaatilisi ja eksperimentaalseid laboris saadud tulemusi. Ta leiutas uusi laboratoorseid aparatuure, millega eksperimente läbi viia. Üheks selliseks oli destillatsiooniaparaat (ingl. k alembic, araabia k. al-anbiq). Jabir uuris keemiliste ainete omadusi, eristades omavahel leelised ja happed.
Jabir ibn-Hayyan järgijaks oli pärslasest alkeemik Al-Razi (u 850–925 pKr), kes tundis huvi pigem alkeemia meditsiiniliste võimaluste kohta. Ta väitis, et metallid koosnevad peamiselt kolmest elemendist:
- elavhõbe iseloomustas voolavust (peamiselt metallide kuumutamisel)
- väävel iseloomustas põlevust
- sool iseloomustas mittevoolavust ja mittesüttivust
Al-Razi uuris ja kirjeldas Jabiri avastatud keemilise elemendi antimoni omadusi. Al-Razi, tuntud ka nimega Rhazes, leiutas mitmeid uusi laboratoorseid seadmeid, millest mõningaid kasutatakse ka tänapäeval, näiteks destillatsioonikolb.[1]
Filosoofide kivi
muudaJabir ibn-Hayyan uuris ühe metalli muundumist teiseks, eeldades, et erinevad metallid on moodustunud elavhõbeda ja väävli segamisel erinevates vahekordades. Jabir arvas, et elavhõbedast kulla või hõbeda saamiseks on vaja ainet, mis soodustaks metalli muundumist. Vana-Kreeka filosoofid nimetasid seda ainet xerion'iks, mis tähendas tõlkes kuivust. Araablased nimetasid seda ainet aga al-iksir'iks ja eurooplased eliksiiriks. Eliksiiril oli kuiv ja mulla omadustega aine, mistõttu kutsuti Euroopas seda filosoofide kiviks. Eliksiiril arvati olevat veel omadus ravida haigusi ning usuti, et eliksiir on imerohi, mis muudab inimesi surematuteks. Alkeemikud uurisid sajandeid eliksiiri mineraloogilisi ja meditsiinilisi omadusi.[1]
Alkeemia areng Euroopas
muudaAraabia päritolu inglise õpetlane Robert Chester oli esimene, kes tõlkis 1144. aastaks araabiakeelsed alkeemiaalased teosed ladina keelde. Tema eeskujul hakkas ka itaalia päritolu õpetlane Gerard Cremona tõlkima araabiakeelseid teoseid (kokku 92 teost) ladina keelde. Tänu ladinakeelsele trükile hakkas alkeemia arenema üle Euroopa. Esimene silmapaistev alkeemik Euroopas oli Albert Bollstadt (u 1200–1280 pKr), tuntud ka Albertus Magnuse nime all. Ta pühendas palju aega Aristotelese avastustele. Albertus Magnus kirjeldas oma eksperimentide abil arseeni, mille olid tõenäoliselt siiski avastanud varasemad alkeemikud.
Inglise päritolu õpetlane ja munk Roger Bacon (1214–1292) kirjeldas püssirohu valmistamist.
Pseudo-Geberi nime all tuntust kogunud keskaja alkeemik kirjeldas 1300. aastal esimest korda tugevaid anorgaanilisi happeid: väävelhapet ja lämmastikhapet. Eelnevalt arvati kõige tugevam hape olevat äädikhape, mida eraldati äädikast.
Saksa füüsik Georg Bauer (1494–1555) ja šveitsi füüsik Theophrastus Bombastus von Hohenheim (1493–1541) võtsid oma uurimistöödes uue suuna. Neid hakkas huvitama meditsiiniline alkeemia (alkeemias keemiat ja meditsiini ühendavat teadusharu nimetati iatrokeemiaks). Bauer ja Von Hohenheim uskusid, et elavhõbeda, väävli ja soola muutus organismis põhjustavad erinevaid haigusi. Von Hohenheim, tuntud nime ka all Paracelsus, uuris ka kulla meditsiinilisi omadusi. Kombineerides elavhõbedat ja väävlit, sai ta "väävli õli", mis osutus dimetüüleetriks.
Saksa alkeemik Andreas Libau (u 1540 – 1616) andis 1597. aastal välja raamatu "Alchemia", mis võttis kokku keskaegse alkeemia avastused ja saavutused. Libau kirjeldas vesinikkloriidhappe saamist tina(IV)kloriidist ja ammooniumsulfaadist. Ta segas omavahel lämmastikhappe ja vesinikkloriidhappe, saadud lahust nimetati kuningveeks, sest see oli võimeline kulda lahustama.
Saksa keemik Johann Rudolf Glauber (1604–1668) sai 1625. aastal kontsentreeritud vesinikkloriidhappe, kui ta lisas lauasoolale (NaCl) kontsentreeritud väävelhappe. Kõrvalsaadusena tekkinud soola naatiumsulfaati nimetatakse glaubrisoolaks ehk mõrusoolaks, millel oli lahtistava toimega omadused. 1648. aastal sai Glauber lämmastikhappe, kuumutades kaaliumnitraati kontsentreeritud väävelhappe juuresolekul.[1]
17.–18. sajand
muuda16. sajandi keemikutele pakkus endiselt huvi metallide saamine maakidest. 1556. aastal ilmus Georg Agricola (1494–1555) kirjutatud raamat "De re metallica", kus autor kirjeldas kõrgtasemel meetodeid metallimaakide kaevandamisest, metallide ekstraheerimisest ja metallurgiast. Agricolat on nimetatud metallurgia isaks.
Aastal 1605 andis inglise filosoof Francis Bacon välja teose "The Proficience and Advancement of Learning", milles kirjeldati teaduslikke meetodeid. Samal aastal ilmus poola alkeemikul ja filosoofil Michal Sedziwójl uurimus "A New Light of Alchemy". 1615. aastal kirjutas Jean Beguin "Tyrocinium Chymicumi", mis oli esimene keemiaõpik, sisaldades esimest keemilise reaktsiooni võrrandit.
1637. aastal andis prantsuse filosoof ja teadlane René Descartes välja raamatu "Discours de methode", milles ta kirjeldas teaduslike meetodite põhimõtteid.
Taani keemik Jan Baptist van Helmont avalikustas oma teadustöö 1648. aastal teosena "Ortus medicinae", milles Helmont kirjeldas alkeemia ja keemia vahelisi seoseid ja erinevusi. Teos oli suureks eeskujuks Robert Boyle'ile. Helmonti teos sisaldas eksperimentaalselt saadud tulemusi ja esialgset versiooni aine massi jäävuse seaduse kohta. Samuti võttis ta kasutusele termini gaas ning arvas, et õhk on erinevate gaaside segu.[1]
Robert Boyle
muudaRobert Boyle on anglo-iiri päritolu keemik, kes on tuntud eeskätt Boyle'i seaduse järgi, mille ta sõnastas 1662. aastal. Boyle'i seadus väidab, et konstantsel temperatuuril on gaasi rõhk pöördvõrdelises seoses tema ruumalaga.
Aasta varem avaldas ta raamatu "The Sceptical Chymist", mis kirjeldas alkeemia ja keemia vahelisi erinevusi ning väitis, et keemia on omaette teadusharu. Ilmunud raamatus võttis Boyle (esimesena maailmas) kasutusele mõisted "element" ja "keemiline analüüs". Robert Boyle'i peetakse ka kaasaegse keemia isaks.[1][2]
Joseph Black
muudaJoseph Black avastas magneesiumkarbonaadi kuumutamise käigus süsinikdioksiidi, mida ta tol ajal nimetas fikseeritud õhuks. Sama gaasi oli võimalik saada ka magneesiumkarbonaadi töötlemisel happega. Ta avastas, et lubjakivi kuumutamisel eraldub sama gaasi ning kui juhtida vastavat gaasi kaltsiumihüdroksiidi vesilahusesse, tekkis sade – kaltsiumkarbonaat. Uurides eraldatud gaasi omadusi, selgus, et see ei soodusta põlemist ega toeta hingamist ning on õhust raskem gaas.
1760. aastal leiutas Joseph Black kalorimeetria, mis tegeleb soojushulkade mõõtmisega. Ta uuris ainete erisoojust, sulamissoojust ja aurustumissoojust.[3]
Henry Cavendish
muudaKuigi vesinik oli avastatud juba varem Robert Boyle'i poolt, oli 1766. aastal Cavendish esimene, kes uuris selle gaasi omadusi, mis tekkis metallide reageerimisel lahjendatud hapetega, ja märkas, et tegemist on uue gaasiga. See gaas oli väga kergesti süttiv ja kergem kui seni avastatud gaasid. Cavendish nimetas seda süttivaks gaasiks. 1783. aastal nimetas Antoine Lavoisier selle gaasi vesinikuks.[4]
Antoine-Laurent Lavoisier
muudaAntoine Lavoisier oli prantsuse keemik, kes muutis keemia kvalitatiivsest kvantitatiivseks. Ta uuris hapniku osalust põlemisreaktsioonides ning taimede ja loomade hingamises, andis nimetused hapnikule, vesinikule ja süsinikule ning tõestas, et vesi koosneb vesinikust ja hapnikust.
1772. aastal uuris Lavoisier teemanti ja sütt ning avastas, et mõlemad eraldavad põledes samasugust gaasi, mida nüüd tuntakse süsinikdioksiidina. Peagi sai Lavoisier'le selgeks, et teemant ja süsi on ühe elemendi erinevad vormid, nimetades selleks elemendiks süsiniku.
Samal aastal avastas Lavoisier, et väävli ja fosfori põlemisel õhu käes tekib hape. Lisaks oli tekkinud saadus raskem kui lähteained, Lavoisier ei osanud esialgu sellele nähtusele seletust tuua. Lavoisier avastas oma uurimiste käigus, et õhuga reageerimine põhjustab happelisuse teket. Tol ajal juba teati, et atmosfääri õhk on erinevate õhkude segu, kuid jäi segaseks, milline komponent põhjustab happelisust. 1774. aastal kohtus ta inglise keemiku Joseph Priestlyga, kes rääkis talle oma avastustest õhu omaduste kohta. Joseph Priestley eraldas hapniku elavhõbeoksiidist ja märkas, et see gaas soodustab põlemist paremini kui atmosfääri õhk. Priestley nimetas avastatud gaasi deflogistoniseeritud õhuks. Samal aastal oli ka Lavoisier eraldanud hapniku ning uurinud selle omadusi. Korrates Priestley eksperimente, sai Lavoisier'le selgeks, et hapnik oligi see atmosfääri õhu komponent, mis põhjustas hapete teket.
Lavoisier pidas oluliseks kvantitatiivseid mõõtmisi, mistõttu ta kaalus nii lähteaineid kui ka saadusi suletud klaaskolvis, et tekkinud gaasid ei lenduks minema. Tulemuste põhjal järeldas Lavoisier, et saaduste mass jääb samaks, mis oli lähteainete mass, kuigi aine ise muutus. 1774. aastal sõnastas ta massi jäävuse seaduse, mis väitis, et suletud süsteemi mass on ajas muutumatu.[1][5]
Jacques Charles
muudaPrantsuse füüsik Jacques Charles uuris 1787. aastal gaasi ruumala ja temperatuuri vahelisi seoseid. Ta leidis, et konstantsel rõhul kasvab gaasi ruumala võrdeliselt temperatuuri tõusuga. Charles ei avalikustanud oma tulemusi. Joseph-Louise Gay-Lussac võttis Charlesi avastused oma eksperimentide aluseks ning avalikustas katsete tulemused 1802. aastal. Seda seaduspärasust nimetatakse Gay-Lussaci seaduseks, mida tuntakse ka Charlesi seadusena.[6]
Joseph Proust
muudaPrantsuse keemik Joseph Proust uuris keemiliste ainete koostist. Ta tegi eksperimente erinevate vaskkarbonaadi proovidega ning leidis võimaluse see keemiliselt lagundada. Proust avastas, et kõik proovid sisaldasid alati kindlas vahekorras samu elemente (vask, süsinik, hapnik). Oma avastuse tõestamiseks analüüsis ta teisi ühendeid ning avastas sama seose. Selle alusel esitas ta 1794. aastal koostise püsivuse seaduse ehk Prousti seaduse, mis väidab, et iga puhas aine sisaldab alati neidsamu keemilisi elemente kindlas kaalulises vahekorras.[7]
19. sajandi algus
muudaKohe 19. sajandi alguses tutvustas itaalia füüsika ja keemik Alessandro Volta esimest keemilist vooluallikat, mille ta oli valmistanud galvaanielemendist. Seda leiutist peetakse elektrokeemia alguseks.
Itaalia keemik Amadeo Avogadro sõnastas 1811. aastal Avogadro seaduse, mis väitis, et kindlal temperatuuril ja kindla rõhu all on kõikide gaaside moolruumalad võrdsed.
19. sajandil hakkas arenema nii orgaaniline, füüsikaline kui ka analüütiline keemia. Sünteesiti orgaanilisi ühendeid ning uuriti nende keemilist struktuuri ja ka omadusi. Josiah Willard Gibbsi põhiline uurimisala hõlmas termodünaamikat ja füüsikalist keemiat. Gibbs uuris vabaenergia sõltuvust keemilisest reaktsioonist. Sellesse perioodi jääb veel Henry Louise Le Chatelieri välja töötatud Le Chatelier' printsiip, mille alusel on võimalik ennustada keemilise tasakaalu nihkumist reaktsiooni tingimuste muutmisel.
John Dalton
muudaInglise keemik, meteoroloog ja füüsik John Dalton esitas 1803. aastal aatomiteooria, mille kohaselt kõik elemendid koosnevad väikestest jagamatutest osakestest, mida nimetatakse aatomiteks. Iga elemendi aatomid on identsed, kuid erinevad teise elemendi aatomitest kuju ja suuruse poolest. Dalton väitis, et aatomid ei teki, kao ega lagune keemiliste reaktsioonide käigus. Erinevate elementide aatomite ühinemisel tekivad keemilised ühendid, näiteks molekulid või kompleksid. Daltoni aatomiteooria põhines kahel seadusel:
1) Lavoisier' massijäävusseadusel, mis väidab, et reaktsiooni saaduste mass võrdub lähteainete massiga ehk suletud süsteemis ei toimu aine lisamist ega eemaldamist;
2) Prousti seadusel ehk koostise püsivuse seadusel, mis väidab, et iga puhas aine sisaldab alati samu keemilisi elemente kindlas kaalulises proportsioonis.
1808. aastal avaldas Dalton oma raamatus "A New System of Chemical Philosophy" keemiliste elementide aatommasside tabeli, kus aatommassiühikuks vastas vesiniku aatomi mass. Samal aastal sõnastas Dalton kordsete suhete seaduse, mis väidab, et kui kaks elementi moodustavad teineteisega mitu keemilist ühendit, siis ühe elemendi ühe ja sama massiga ühinenud teise elemendi massid suhtuvad omavahel alati kui lihtsad täisarvud.[8]
Jöns Jacob Berzelius
muudaJöns Jacob Berzelius oli rootsi keemik, kes kontrollis eksperimentaalselt John Daltoni aatomiteooriat ning nii koostise püsivuse kui ka kordsete suhete seadust. 1808. aastal andis Berzelius välja keemiaõpiku, mis põhines nii tema kui ka ta õpilaste eksperimentide tulemustel. Berzeliuse uurimised viisid ta mitme uue elemendi avastamiseni, näiteks tseeriumi, seleeni, räni, vanaadiumi ja tooriumi. Lisaks uute elementide avastamisele uuris ta selleks ajaks teada olevate keemiliste elementide aatommasse ja koostas nende põhjal perioodilisustabeli, kus hapniku aatommassiks määras ta 100. Erinevalt Daltonist hakkas Berzelius kasutama elementide sümboleid, mis põhinesid elementide ladinakeelsetel nimetustel, sest ta leidis, et nii oli lihtsam kirja panna ühendite keemilisi valemeid. Võrreldes nüüdisaegse kirjapildiga, märkis Berzelius valemis allindeksite asemel ülaindekseid. 1828. aastal avaldas Berzelius perioodilisustabeli elementide aatommasside alusel, jagades keemilised elemendid metallideks ja mittemetallideks.
Koos inglise keemiku H. Davyga uuriti soola hüdrolüüsi ning avastati, et elementide aatomid jagunevad kaheks: elektronegatiivseteks ja elektropositiivseteks. Elektrivoolu abil määrati nii vee kui ka erinevate soolalahuste keemilise koostise valemid. Berzelius arvas, et kõik anorgaanilised ühendid koosnevad positiivselt ja negatiivselt laetud osakestest, mis tänu vastaslaengutele omavahel tõmbuvad.
Jöns Jacob Berzelius võttis esimesena keemias kasutusele mõisted katalüüs, polümeer, isomeer ja allotroop. Lisaks jagas ta ühendid anorgaanilisteks ja orgaanilisteks ning nimetas 1838. aastal taani keemiku Gerardus Johannes Mulderi uuritud orgaanilised ühendid proteiinideks.[9]
Orgaanilise keemia algus
muuda19. sajandit võib pidada orgaanilise keemia alguseks, kuni selle ajani arvati, et orgaanilised ühendid tekivad vaid elusorganismides elujõu toimel (via vitalis). William Proust jagas 1827. aastal biomolekulid kolme rühma: karbohüdraadid, proteiinid ja lipiidid.[10]
Aasta hiljem sünteesis Friedrich Wöhler esimest korda uurea, tõestades sellega, et orgaanilisi ühendeid on võimalik sünteesida ka anorgaanilisest lähteainest. 1832. aastal kirjeldavad Friedrich Wöhler ja Justus von Liebig erinevaid funktsionaalseid rühmasid ja radikaale ning nende seost orgaanilise keemiaga. Need saavutused lükkasid ümber väite, et orgaanilised ühendid tekivad vaid vitalismi teooria järgi.[11]
William Henry Perkin on tuntuks saanud tänu sellele, et proovis 1856. aastal toota hiniini, kuid saadud produktiks oli orgaaniline värvaine, mis sai nimeks Perkini lilla. 1865. aastal sünteesis Adolf von Baeyer indigo värvi, mida võib nimetada tänapäeva värvitööstuse algusajaks.[12]
Üheks suureks läbimurdeks orgaanilise keemia ajaloos oli 1858. aastal Friedrich August Kekulé ja Archibald Scott Couperi avastatud orgaanilise aine keemiline struktuur. Mõlemad teadlased pakkusid välja, et süsiniku aatom on tetravalentne ja orgaanilises ühendis on süsinikud omavahel ühendatud süsinikahelaks. Aastaid hiljem esitles Friedrich August Kekulé benseenituuma keemilist struktuuri, pakkudes välja, et benseen koosneb 6 süsinikulisest tsüklist, kus süsinikud on vaheldumisi omavahel seotud üksik- ja kaksiksidemetega.[13]
1884. aastal esitas Hermann Emil Fischer puriini struktuuri, mida ta pidas paljude biomolekulide struktuuride aluseks. Esimest korda sünteesis Fischer puriini 1898. aastal. Lisaks huvitasid teda sahhariidide keemiline struktuur ja omadused ning ta uuris nii glükoosi kui ka teisi sahhariide.[14]
Perioodilisustabeli leiutamine
muuda1808. aastal avalikustas John Dalton perioodilisustabeli, mis koosnes 20 keemilise elemendi ringikujulisest sümbolist ja põhines nende suhtelistel aatommassidel. 1827. aastal avaldas ta uue perioodilisustabeli, mis koosnes juba 36 elemendist. Aasta hiljem esitas Berzelius perioodilisustabeli, mis koosnes 49 tuntud elemendist. Tabelisse olid kantud elementide sümbolid ja aatommassid.
1829. aastal avastas saksa keemik Johann Wolfgang Döbereiner, et osal elementidel on sarnased füüsikalised omadused, mis moodustasid kolmest elemendist koosnevaid rühmasid. Katsete käigus ilmnes, et rühmadesse paigutatud elementidel on ka sarnased keemilised omadused. Nii moodustus sarnaste omaduste põhjal 6 rühma: 1) liitium, kaalium, naatrium; 2) kaltsium, strontsium, baarium; 3) kloor, broom, jood; 4) väävel, seleen, telluur; 5) süsinik, lämmastik, hapnik; 6) raud, koobalt, nikkel. Neid rühmi kutsutakse Döbereineri triaadideks.
Itaalia keemik Stanislao Cannizzaro avalikustas keemiliste elementide aatommassid, nimetades vesiniku aatommassi universaalseks standardiks. Tänu Cannizzarole märkas prantsuse geoloog A. E. Beguyer de Chancourtois, et sarnaste keemiliste ja füüsikaliste omadustega elemendid korduvad periooditi. Ta koostas 1862. aastal silindrikujulise perioodilisustabeli, mille keskel asus telluur, mistõttu on see saanud nimetuse "telluuri heeliks". Kohakuti paiknevate elementide omadused olid sarnased.
1864. aastal jagas inglise keemik John Newlands 62 keemilist elementi kaheksasse rühma nende aatommasside kasvu järjekorras. Newlands märkas, et elemendid, mille aatommassid erinevad arvu seitse poolest, on sarnaste omadustega, ja nimetas seda oktavite seaduseks. Newlands ei jätnud koostatud perioodilisustabelisse ruumi veel seni avastamata keemilistele elementidele, mistõttu ta mõistis seaduse ebatäiuslikkust. Tema avastust ei võetud tõsiselt, kuni Mendelejev leidis samasuguse seaduspärasuse elementide paiknemisel perioodilisustabelis.
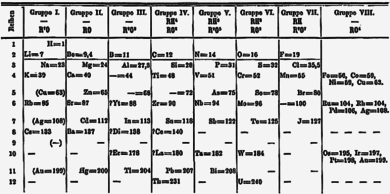
Saksa keemik Lothar Meyer tabel põhines esmalt 28 elemendil, mis olid organiseeritud rühmadesse valentsi põhjal. Aastal 1868 täiendas ta esialgset tabelit, lisades sinna ka siirdemetallid. Tabel põhines elementide aatommassidel ning samasugust valentsi omavad elemendid paiknesid üksteise all. Meyeri tabel avalikustati alles 1870. aastal, kusjuures 1869. aastal ilmus Dmitri Mendelejevi tabel. Mõlema keemiku perioodilisustabelid olid väga sarnased, kuid kumbki polnud teadlik teise avaldatud tööst.
Vene keemik Dmitri Mendelejev tegi iga elemendi kohta kaardi, mis sisaldas elemendi sümbolit, aatommassi ning selle keemilisi ja füüsikalisi omadusi. Ta paigutas elemendid tabelisse sarnaste omaduste ja aatommassi kasvamise järgi ning jättis tabelisse tühjad kohad veel avastamata elementidele. 1875. aastal avastati gallium, mis oli üheks elemendiks, mida Mendelejev oli ennustanud.
1892. aastal avastas William Ramsay väärisgaasid. Kuigi Mendelejevi tabelis nende jaoks kohta ennustatud polnud, siis tegelikult väärisgaaside avastamine hoopis kinnitas Mendelejevi perioodilisustabeli seaduspärasust. Väärisgaasid said tabelis viimase – 8. rühma. Väärisgaaside valents on null, mistõttu on need väga stabiilsed ega reageeri teiste ainetega.[15][16]
Aatomi ehitus
muuda1897. aastal avastas Joseph John Thomson elektronide olemasolu. Aasta hiljem leidis Wilhelm Wien, et kui on olemas negatiivsed osakesed, peavad olema tuumas ka positiivse elektrilaenguga osakesed, mida hakati nimetama prootoniteks (nimetuse "prooton" võttis kasutusele Rutherford 1920. aastal[viide?]). Aatomi ehitust kinnitas Ernest Rutherford 1907. aastal, kui ta pommitas aatomeid radioaktiivsetest ainetest pärinevate osakestega. Ta avastas, et alfaosakeste kiirgus läbib ainet. Mõõtes alfaosakeste kõrvalekallet õhukese ainekihi läbimisel, jõudis ta 1911. aastal järeldusele, et aatomid koosnevad raskest positiivselt laetud tuumast ning seda ümbritsevatest negatiivselt laetud elektronidest.[17]
Viited
muuda- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 Isaac Asimov. A Short History of Chemistry. New York: Doubleday & Company, Inc. 1965.
- ↑ Chemical Heritage Foundation. "Robert Boyle".
- ↑ Alan Cooper (1999). "Joseph Black". Originaali arhiivikoopia seisuga 4. detsember 2016. Vaadatud 18. jaanuaril 2017.
- ↑ Encyclopedia of World Biography. "Henry Cavendish Biography".
- ↑ Famous Scientists. "Antoine Lavoisier". 2015.
- ↑ "Jacques Alexandre César Charles". Centennial of Flight. U.S. Centennial of Flight Commission. 2001. Originaali arhiivikoopia seisuga 24. veebruar 2007. Vaadatud 18. jaanuaril 2017.
- ↑ Mary Bagley. "History of Chemistry. Famous Chemists". 2014.
- ↑ "John Dalton". Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation.
- ↑ "Jöns Jacob Berzelius". Chemical Heritage Foundations. 2015. Originaali arhiivikoopia seisuga 28. oktoober 2016.
- ↑ "William Prout". Originaali arhiivikoopia seisuga 26.09.2007. Vaadatud 12.03.2007.
- ↑ "Justus von Liebig and Friedrich Wöhler". Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. 2005.
{{cite web}}: puuduv või tühi|url=(juhend) - ↑ "William Henry Perkin". Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. 2005.
{{cite web}}: puuduv või tühi|url=(juhend) - ↑ "Archibald Scott Couper and August Kekulé von Stradonitz". Chemical Achievers: The Human Face of Chemical Sciences. Chemical Heritage Foundation. 2005. Originaali arhiivikoopia seisuga 28. märts 2017. Vaadatud 18. jaanuaril 2017.
- ↑ "Emil Fischer: The Nobel Prize in Chemistry 1902". Nobel Lectures, Chemistry 1901–1921. Elsevier Publishing Company. 1966.
- ↑ "A BRIEF HISTORY OF THE DEVELOPMENT OF PERIODIC TABLE".
- ↑ Royal Society of Chemistry. "Development of the periodic table".
- ↑ Lee Buescher. "Atomic Structure Timeline". Originaali arhiivikoopia seisuga 10. veebruar 2015. Vaadatud 18. jaanuaril 2017.