Grignardi reaktsioon
See artikkel ootab keeletoimetamist. |
Grignardi reaktsioon on metallorgaaniline keemiline reaktsioon, mis koosneb kahest etapist: Grignardi reaktiivi valmistamisest ja selle reaktsioonist sobiva orgaanilise või anorgaanilise substraadiga (tavaliselt substraadina kasutatakse aldehüüde või ketoone). Grignardi reaktiiv moodustub magneesiumi reaktsioonil orgaanilise halogeniidiga sobivas solvendis.[1]

Seda reaktsiooni uuris prantsuse keemik François Auguste Victor Grignard Philippe A. Barbier juhendamisel (Nancy Ülikool, Prantsusmaa) ja sai selle eest 1912. aasta Nobeli auhinna keemias[2].
Grignardi reaktsiooni kasutatakse laialt nii tööstuses kui ka laborites vajalike keemiliste ühendite sünteesimiseks. Grignardi reaktiivid on sarnased liitiumorgaaniliste ühenditega, mõlemat liiki reaktiivid on tugevad nukleofiilid ja saavad moodustada uusi süsinik-süsinik (-C-C-) sidemeid.
Reaktsiooni mehhanism
muudaGrignardi reaktiiv käitub nukleofiilina, rünnates karbonüülrühma elektrofiilset tsentrit. Grignardi reaktiivi liitumine karbonüülrühmale toimub tavaliselt kuueliikmelise ringvaheühendi läbi.[3]
Samal ajal kasutades steeriliselt varjatud Grignardi reaktiive võib liitumisreaktsioon toimuda läbi ühe elektroni ülemineku. Selline toimumismehhanism kehtib ka Grignardi reaktiivi ja süsinik-heteroaatomi (-C-X-, kus X on Sn, Si, B jms) vaheliste reaktsioonide korral.
Grignardi reaktiivi valmistamine
muudaGrignardi reaktiiv moodustub sobiva orgaanilise halogeniidi (arüül- või alküülhalogeniidi) reageerimisel metallilise magneesiumiga. Reaktsioon viiakse läbi lisades orgaanilist halogeniidi magneesiumi suspensioonile. Tavaliselt kasutatakse eeterlikke solvente (nt dietüüleetrit), mis annavad magneesiumorgaanilise reaktiive stabiliseerivaid ligande. Empiiriliselt ennustatakse, et Grignardi reaktiivi moodustumisreaktsioon toimub metalli pinnal läbi ühe elektroni ülemineku.[4][5][6] Läbi teise elektroni ülemineku on võimalik radikaalidest karbanioni teke.[7][8]
- R−X + Mg → R−X•− + Mg•+
- R−X•− → R• + X−
- R• + Mg•+ → RMg+
- RMg• + X•- → RMgX
Grignardi reaktiivid osalevad transmetalleerimise reaktsioonides:
- RMgX + ArX → ArR + MgX2
Reaktsioonitingimused
muudaGrignardi reaktsioon peab olema läbi viidud vee- ja hapnikuvabades tingimustes, vastasel juhul toimub Grignardi reaktiivi aeglane oksüdeerumine või protolüüs. Ketooni või aldehüüdi lisamisel võib toimuda Grignardi reaktsiooni ootamatu initsieerimine ning plahvatus. Reaktsioone viiakse tihti läbi tetrahüdrofuraanis (THF) või dietüüleetris, mille aurud kaitsevad reaktsioonikeskkonda kõrvalreaktsioonide eest, mis võivad tuleneda niiskusest ja õhus leiduvast hapnikust. Teostades reaktsiooni mikrokogustega on võimalik seda läbi viia argooni või lämmastiku atmosfääris või glove-box'is. Kasutatavad reaktiivid peavad kindlasti olema kuivad ja veevabad, kuigi rakendades ultraheli on võimalik läbi viia Grignargi reaktsiooni ka mitteveevabas solvendis.[9]
Solvent
muudaSolvendiks kasutatakse tavaliselt dietüüleetrit, THF-i, dioksaani või mittepolaarseid süsivesinikke. Solventi tuleb valida hoolikalt, mõeldes mitte ainult selle hinna peale, vaid ka selle struktuuri, ohutuse ja reaktsioonivõimelisuse ning reaktiivide lahustuvuse peale. Sobiv solvent võib märgatavalt parandada reaktsiooni saagist ja mõjutada produkti stereokeemiat.
Orgaaniline halogeniid
muudaOrgaaniline halogeniid R-X võib oluliselt mõjutada reaktsiooni kiirust, selektiivsust, vaheühendite ning produkti struktuure ja saagist. Halogeeni X reaktsioonivõime kahaneb reas I > Br > Cl >> F, seepärast Grignardi reaktsioonis kasutatakse tavaliselt alküül- ja arüülbromiide ja jodiide, harvemini kloriide. Ftoriide kasutatakse ainult reaktsioonides spetsiifiliselt aktiveeritud magneesiumiga.
Orgaaniline rühm R mõjutab reaktsiooni samamoodi kui halogeniid. Reaktsioonivõime kahaneb reas allüül, bensüül > primaarne alküül > sekundaarne alküül, tsükloalküül ≥ tertsiaarne alküül, arüül > vinüül. Mõnikord tuleb arvesse võtta ka Grignardi reaktiivi reaktsioonivõimelisust ja kasutada kaitserühmasid mõnede orgaaniliste halogeniidi rühmade kaitsmiseks, mis omakorda saavad reageerida magneesiumühendiga.[10]
Reaktsiooni initsieerimine
muudaGrignardi reaktiivi moodustumisreaktsioonil võib olla teatud initsieerimisperiood, mille jooksul reaktsioon toimub väga aeglaselt. Põhiliselt sõltub selle perioodi pikkus magneesiumi ja orgaanilise halogeniidi kokkupuutepinna suurusest, seepärast kasutatakse erinevaid meetodeid selle pinna suurendamiseks: magneesiumi pinna aktiveerimine, magneesiumi peenestamine, reaktsiooni segu kiire segamine, initsiaatorite kasutamine (jood, metüüljodiid, 1,2-dibromoetaan), ultraheli rakendamine[11].
Kasutades initsiaatorit, on parem valida 1,2-dibromoetaani, kuna selle toimet on võimalik jälgida etüleeni mullikeste eraldumise järgi. Kõrvalproduktide teke on minimaalne.
Magneesium
muudaKuigi tihti kasutatakse laboritingimustes lihtsalt pulbrilist magneesiumi, on olemas mitmeid tehnikaid magneesiumi keemiliseks või füüsikaliseks aktiveerimiseks. Nende üldisteks eesmärkideks on magneesiumi pinna puhastamine või keemiline aktiveerimine. Lisaks on võimalik osta juba spetsiifiliselt aktiveeritud Rieke'i magneesiumi.
Rieke'i magneesium
muudaÜldjuhul spetsiifiliselt aktiveeritud magneesiumi saadakse selle soolade redutseerimisel leelismetallidega veevabas eeterlikus või süsivesinikke solvendis, tavaliselt argooni atmosfääris. On võimalik ka katalüsaatori kasutamine (naftaleen, mõnikord leelismetalli naftaleniid). Saadud magneesiumi eeliseks on eriti puhas pind.
Mineraalhappega puhastamine
muudaMagneesiumi pinna puhastamisel oksiidsest kihist pestakse magneesiumi mineraalhappega, seejärel lihvitakse ja peenestatakse. Miinuseks on see, et selle meetodiga ei ole võimalik puhastada korraga suures koguses magneesiumi.
Dry-Stir meetod
muudaSee meetod võimaldab füüsikaliselt puhastada magneesiumi pinda, segades seda teflonist segajaga Schlenki torus lämmastiku atmosfääris, mille tagajärjel vähenevad magneesiumi osakeste mõõtmed ja värvus muutub heledamaks. Hiljem valatakse puhastatud magneesiumi peale sobiv solvent ja sünteesitakse vajalik Grignardi reaktiiv.
Gilmani katalüsaator
muudaGilmani katalüsaatori kasutamisel lisatakse väikesed kogused magneesiumi ja joodi benseeni lämmastiku atmosfääris. Järgnevalt lisatakse saadud segule dietüüleetrit magneesiumi aktiveerimiseks kuni joodi värvuse kadumiseni. Saadud aktiveeritud magneesiumi on võimalik salvestada ja kasutada hiljem.
Ultraheli rakendamine
muudaAlternatiivne meetod magneesiumi aktiveerimiseks on ultraheli rakendamine, mis võimaldab läbi viia Grignardi reaktsiooni ka mitteveevabas solvendis: ultraheli toimel toimub magneesiumi pinnalt adsorbeerunud vee eemaldamine.[12]
Analüüsimine
muudaArvestades Grignardi reaktiivi ebastabiilsust ja tundlikkust vee ja hapniku suhtes, on väljatöötatud mitu meetodit moodustunud aktiivse Grignardi reaktiivi koguse määramiseks. Tavaliselt kasutatakse potentsiomeetrilist tiitrimist 2-butanooliga titrandi rollis. Selle meetodi eelised on selles, et Mg-OH või Mg-OR ühendid ei reageeri titrandiga, lisaks see ei ole ajamahukas ja on hästi reprodutseeritav. Sama tiitrimist saab teostada ka kasutades värvusindikaatorit, kuigi meetodi viga on sel korral suurem, aga tavaliselt jääb siiski aktsepteeritud piiridesse. Lisaks tavaline tiitrimine on potentsiomeetrilisest palju odavam.
Ühtlasi saab kasutada ka gaasikromatograafiat, valides sobiv kolonni ja temperatuuriprogrammi. Keerulisemad analüüsid, nt Grignardi reaktiivide struktuuri määramine, teostatakse kasutades infrapunast, Ramani ja TMR-spektroskoopiat.[13]
Ohutustehnika
muudaGrignardi reaktsioon on eksotermiline, seepärast tuleb Grignardi reaktiivi valmistada veevabas keskkonnas, vastasel juhul on reaktsioonisegu plahvatusohtlik. Tuleb arvestada ka mõne kasutatava reaktiivi toksilisust ja plahvatusohtlikkust, sellest tuleb teada saada enne sünteesi alustamist.
Grignardi reaktiivi tööstuslik valmistamine
muudaViies läbi Grignardi reaktsiooni tööstuslikes tingimustes, tuleb arvesse võtta, milliseid koguseid lähteaineid on plaanis kasutada ja millise konfiguratsiooniga ning millisest materjalist reaktsioonianumaid on kasutusel, lisaks ka reaktsiooni eksotermilisust. Tuleb arvestada ka näiteks suhet pind/ruumala, millest tuleneb protsesside teatud inertsus (tööstuslik anum soojeneb tunduvalt aeglasemalt kui kolb). Probleemiks on ka reaktsiooni initsiatsioon, see lahendatakse lisades uuele reaktsioonisegule Grignardi reaktiivi portsjon eelmisest partiist, mis aitab eemaldada vett ja alustada uut reaktsiooni.[14]
Tööstuslikult läbi viidud reaktsiooni maksumus on suurem võrreldes laboritingimustes läbi viidud reaktsiooni omaga. Suurem on ka ökoloogiline mõju ja raskem on jääkide utiliseerimine.
Grignardi reaktiivi reaktsioonid
muudaÜldine reegel: reaktsiooni kiirus ja saagis sõltub lahkuva rühma iseloomust. Lahkuva rühma headus sõltub selle ja süsiniku vahelise sidemete polaarsusest, üldine rida on halogeenid > OR >> SR, CN...
Probleemiks võib osutuda konkureerivate reaktsioonide olemasolu, mis on vahetult seotud Grignard reaktsiooni mehhanismiga.
Reaktsioonid karbonüülühenditega
muudaGrignard reaktiivid saavad reageerida erinevate karbonüülühendite derivaatidega[15].
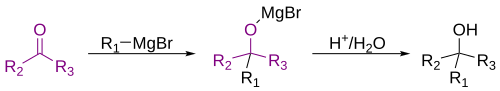
Kõige tavalisem Grignardi reaktiivi kasutamisviis on aldehüüdide ja ketoonide alküülimine[16]:
Tuleb märkida, et atsetaal reaktsioonis ei osale!
Sellised reaktsioonid nõuavad tavaliselt saadud produktide töötlemist mineraalhappe vesilahusega, et lahutada tekkinud ühendeid. Juhul kui Grignardi reaktiiv liitub prokiraalsele aldehüüdile või ketoonile, aitavad Felkini-Ahni mudel või Crami reegel ennustada tekkivat stereoisomeri. 1,3-diketooni ja Grignardi reaktiivi vahelises reaktsioonis käitub Grignardi reaktiiv RMgX alusena, reaktsioonis moodustuvad enolaatioon ja alkaan RH.
Reaktsioonid teiste elektrofiilidega
muudaGrignardi reaktiivid saavad reageerida ka teiste elektrofiilset tsentrit sisaldavate ühenditega, käitudes ühtlasi nii nukleofiilina, kui ka protoonse substraadina.
Bromoetaani/jodoetaani ja magneesiumi vaheline reaktsioon fenooliga THF lahuses annab C6H5-OMgBr ühendi. Pärast benseeni lisamist ja solvendi liia aurutamist, lisatakse paraformaldehüüdi ning trietüülamiini ja saadakse põhiproduktina salitsüülaldehüüd (reaktsiooni segu nõuab töötlemist 10% HCl).[17]
Süsinik-heteroaatom sidemete moodustumine
muudaSarnaselt liitiumorgaaniliste ühenditega on võimalik kasutada Grignardi reaktiive süsinik-heteroaatom (-C-X-, kus X võib olla Sn, Si, Ge, P, B jms) sidemete moodustamiseks.
Reaktsioonid d-metallide halogeniididega
muudaGrignardi reaktiivid saavad reageerida ka metalliliste elektrofiilidega, osaledes nt transmetalleerimise reaktsioonides näiteks kaadmiumkloriidiga (CdCl2):
- 2 RMgX + CdCl2 → R2Cd + 2 Mg(X)Cl
Moodustunud dialküülkaadmiumi[18] kasutatakse ketoonide valmistamiseks atsüülhalogeniididest:
- 2 R'C(O)Cl + R2Cd → 2 R'C(O)R + CdCl2
Süsinik-süsinik liitumisreaktsioonid
muudaGrignardi reaktiivid saavad osaleda ka liitumisreaktsioonid. Näiteks nonüülmagneesiumbromiid reageerib metüül-p-klorobensoaadiga andes p-nonüülbensoe hapet. Kaitserühmaks kasutatakse tris(atsetoatsetonato)raud(III) (Fe(acac)3), ilma selleta Grignardi reaktiiv reageeriks tõenäolisemini estri rühmaga, mitte arüülhalogeniidiga. Reaktsiooni segu töödeldakse NaOH lahusega, et hüdrolüüsida estrit.[19]
Arüülhalogeniide ja Grignardi reaktiivide liitumisreaktsioonides kasutatakse katalüsaatorina nikkel(II)kloriidi THF-s. Alküülhalogeniidide puhul on katalüsaator diliitium tetraklorocupraat (Li2CuCl4), mida saadakse liitiumkloriidi (LiCl) segamisel vask(II)kloriidiga (CuCl2) THF-s.
Oksüdeerimine
muudaGrignardi reaktiivi töötlemine hapnikuga annab magneesiumiorgaanilist peroksiidi, mille hüdrolüüs annab kas alkoholi või hüdroperoksiidi. Reaktsiooni käigus tekib radikaal vaheühendina.
Lihtsalt Grignardi reaktiivi oksüdeerimine annab vastava alkoholi, kuigi saagis on tavaliselt madal, mispärast oksüdeerimisreaktsiooni tihti ei kasutata. Samal ajal on kasutatav kaheetapiline Grignardi reaktiivi reaktsioon boraaniga, mille produkti oksüdeerimisel vesinikperoksiidiga saadakse vastav alkohol.
Elimineerime
muudaGrignardi reaktiivi liitumine teatud ühenditele, millel on β-positsioonis hea lahkuv rühm, võib põhjustada ka elimineerimisreaktsioone (Boord olefiini süntees). Seda tüüpi reaktsioonid võivad osutuda Grignardi reaktiivide kasutamist piiravaks teguriks.
Grignardi reaktiivide degradeerumine
muudaKunagi kasutati Grignardi reaktiivi degradeerumist halogeeni aatomite arvu määramiseks mõnedes orgaanilistes ühendites[20]. Tänapäeval kasutatakse seda omadust mõnede triatsüülglütseroolide analüüsiks.[21]
Tööstuslik kasutamine
muudaTamoksifeeni süntees
muudaÜheks Grignardi reaktiivi rakenduseks on tamoksifeeni[22] süntees. Tamoksifeeni kasutatakse rinnavähi ravimiseks.
Naprokseeni süntees
muudaNaprokseen on ka mõnede ravimite komponent. Selle sünteesis kasutatakse samamoodi Grignardi reaktiivi.
Galerii
muuda-
Magneesium reaktsioonikolvis.
-
Nüüd kaetud THF kihiga, kristallike joodi lisatud.
-
Kuumutamise jooksul lisatakse alküülbromiidi lahus.
-
Pärast lisamise lõppu reaktsiooni segu kuumutatakse veel mingi aja jooksul.
-
Grignardi reaktiiv on moodustunud. Väike kogus magneesiumi on jäänud kolvi põhjale.
-
Grignardi reaktiivi lahus jahutatakse 0 °C-ni enne karbonüülühendi lisamist. Lahus muutub häguseks – Grignardi reaktiiv sadeneb välja.
-
Karbonüülühendi lahus lisatud.
-
Reaktsiooni segu soojendatakse ruumitemperatuurini. Soovitatav ühend on tekkinud.
Viited
muuda- ↑ Handbook of Grignard Reagents, Silverman, G. S., Rakita, P. E.; Marcel Dekker, New York, 1996; pp 1–2. ISBN 0-8247-9545-8.
- ↑ Grignard, V. (1900), "Sur quelques nouvelles combinaisons organométaliques du magnésium et leur application à des synthèses d'alcools et d'hydrocabures", Compt. Rend., 130: 1322–1325
- ↑ Maruyama, K.; Katagiri, T. (1989), "Mechanism of the Grignard reaction", J. Phys. Org. Chem 2 (3): 205, doi:10.1002/poc.610020303
- ↑ Garst, J. F.; Ungvary, F. "Mechanism of Grignard reagent formation". In Grignard Reagents; Richey, R. S., Ed.; John Wiley & Sons: New York, 2000; pp 185–275. ISBN 0-471-99908-3.
- ↑ F.A. Carey, R.J. Advanced Organic chemistry Part B: Reactions and Synthesis. Sundberg 2nd Ed. 1983
- ↑ Rogers, H. R.; Hill, C. L.; Fujiwara, Y.; Rogers, R. J.; Mitchell, H. L.; Whitesides, G. M. (1980). "Mechanism of formation of Grignard reagents. Kinetics of reaction of alkyl halides in diethyl ether with magnesium". Journal of the American Chemical Society 102 (1): 217.
- ↑ de Boer, H.J.R.; Akkerman, O.S; Bickelhaupt, F. "Carbanions as intermediates in the synthesis of Grignard Reagents", Angew. Chem. Int. Ed. 27, 687 – 689, 1988.
- ↑ van Klink, G.P.M.; de Boer, H.J.R; Schat, G.; Akkerman, O.S.; Bickelhaupt, F.; Spek, A. "Carbanions as Intermediates in the Formation of Grignard Reagents", Organometallics 21, 2119–2135, 2002.
- ↑ Smith, David H. (1999), "Grignard Reactions in "Wet" Ether", Journal of Chemical Education 76 (10): 1427, Bibcode 1999JChEd..76.1427S, doi:10.1021/ed076p1427
- ↑ Handbook of Grignard Reagents, Silverman, G. S., Rakita, P. E.; Marcel Dekker, New York, 1996; pp 13–15. ISBN 0-8247-9545-8.
- ↑ Smith, David H. (1999). "Grignard Reactions in "Wet" Ether". Journal of Chemical Education. 76 (10): 1427. Bibcode:1999JChEd..76.1427S. DOI:10.1021/ed076p1427. Vaadatud 26. veebruar 2012.
- ↑ Handbook of Grignard Reagents, Silverman, G. S., Rakita, P. E.; Marcel Dekker, New York, 1996; pp 53–75. ISBN 0-8247-9545-8.
- ↑ Handbook of Grignard Reagents, Silverman, G. S., Rakita, P. E.; Marcel Dekker, New York, 1996; pp 89–115. ISBN 0-8247-9545-8.
- ↑ Handbook of Grignard Reagents, Silverman, G. S., Rakita, P. E.; Marcel Dekker, New York, 1996; pp 79–82. ISBN 0-8247-9545-8.
- ↑ Henry Gilman and R. H. Kirby (1941), "Butyric acid, α-methyl-", Org. Synth.; Coll. Vol. 1: 361
- ↑ Haugan, Jarle André; Songe, Pål; Rømming, Christian; Rise, Frode; Hartshorn, Michael P.; Merchán, Manuela; Robinson, Ward T.; Roos, Björn O. et al. (1997), "Total Synthesis of C31-Methyl Ketone Apocarotenoids 2: The First Total Synthesis of (3R)-Triophaxanthin", Acta Chimica Scandinavica 51: 1096–1103, doi:10.3891/acta.chem.scand.51-1096, retrieved 2009-11-26
- ↑ Peters, D. G.; C. Ji. J. Chem. Educ., 2006, 83 (2), p 290 http://pubs.acs.org/doi/abs/10.1021/ed083p290
- ↑ "Unit 12 Aldehydes, Ketones and Carboxylic Acids". Chemistry Part II Textbook for class XII (PDF). Kd 2. India: National Council of Educational Research and Training. 2010. Lk 355. ISBN 81-7450-716-7.[alaline kõdulink]
- ↑ A. Fürstner, A. Leitner, G. Seidel (2004), "4-Nonylbenzoic Acid", Org. Synth. 81: 33–42
- ↑ Steinkopf, Wilhelm; V. Petersdorff, Hans-JüRgen (1940), "Studien in der Thiophenreihe. LI. Atophanartige Derivate des Dithienyls und Diphenyls", Justus Liebig s Annalen der Chemie, 543: 119, DOI:10.1002/jlac.19405430110
- ↑ Myher JJ, Kuksis A (1979), "Stereospecific analysis of triacylglycerols via racemic phosphatidylcholines and phospholipase C", Can. J. Biochem., 57 (2): 117–24, DOI:10.1139/o79-015, PMID 455112
{{citation}}: eiran tundmatut parameetrit|month=(juhend) - ↑ Jordan VC (1993), "Fourteenth Gaddum Memorial Lecture. A current view of tamoxifen for the treatment and prevention of breast cancer", Br J Pharmacol, 110 (2): 507–17, PMC 2175926, PMID 8242225