Kolmikpunkt
Kolmikpunkt on ühekomponendilise aine jaoks kindel punkt rõhu–temperatuuri diagrammil. Sellele punktile vastab temperatuuri ja rõhu väärtuste paar, mille puhul aine kolm faasi (tavaliselt agregaatolekut) on omavahel termodünaamilises tasakaalus.[1] Nende faaside vahel võib toimuda kolm faasisiiret: tahke↔vedel, vedel↔gaasiline, tahke↔gaasiline. Kolmikpunktis lõikuvad kõigi kolme faasipaari tasakaalukõverad.
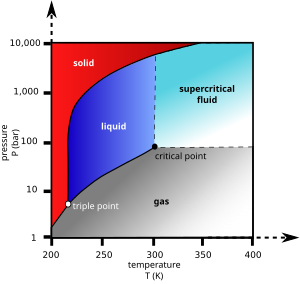
Näiteks vee kolmikpunk on temperatuuril 273,16 K (0,01 °C) ja rõhul 611,657 (± 0,010) Pa (umbes 0,006 baari). Vee keemistemperatuur on normaaltingimustel 100 °C, kuid rõhu vähendamisel see langeb, nii et vaakumi lähedal ühtib keemispunkt jää sulamispunktiga. Kolmikpunktis on jääst, veest ja aurust koosnev termodünaamiline süsteemm tasakaalus. Kolmikpunktile vastavast rõhust madalamal muutub jää otse auruks ja vastupidi, vedel faas puudub.
Tahkeid faase võib vastavalt kristallimodifikatsioonidele olla rohkem kui üks, seetõttu võib ühel ainel olla erinevaid kolmikpunkte, kus on näiteks tasakaalus kaks tahket faasi ja üks vedel faas või kaks tahket faasi ja üks gaasiline faas.
| Aine | Temperatuur | Rõhk | ||
|---|---|---|---|---|
| Nimetus | Valem | K | °C | kPa |
| Vesi | H2O | 273,16 | 0,01 | 0,611657 |
| Hapnik | O2 | 54,361 | −218,789 | 0,14633 |
| Süsihappegaas | CO2 | 216,592 | −56,558 | 517,95 |
| Lämmastik | N2 | 63,151 | −209,999 | 12,523 |
| Ammoniaak | NH3 | 195,5 | −77,65 | 6,1 |
| Elavhõbe | Hg | 234,3 | −38,8 | 1,65·10−4 Pa |
| Osalevad faasid | Temperatuur | Rõhk (MPa) |
|---|---|---|
| vedel vesi, jää Ih, veeaur | 0,01 °C | 0,000 611 657 |
| vedel vesi, jää Ih, jää III | −22 °C | 209,9 |
| vedel vesi, jää III, jää V | −17 °C | 350,1 |
| vedel vesi, jää V, jää VI | 0,16 °C | 632,4 |
| jää Ih, jää II, jää III | −35 °C | 213 |
| jää II, jää III, jää V | −24 °C | 344 |
| jää II, jää V, jää VI | −70 °C | 626 |
Vaata ka
muudaViited
muuda- ↑ Pärtel, E., 2010. Füüsika mõisted gümnaasiumile (eesti-vene-eesti sõnastik). Tartu Ülikooli Kirjastus.