Kiraalne molekul
Keemias tähendab kiraalsus molekuli struktuuris sümmeetria puudumisega seotud omadust, mistõttu kiraalne molekul (ehk käeline molekul) ei ole ühildatav tema peegelpildile vastava konfiguratsiooniga molekuliga. See tähendab, et esineb kiraalse molekuli peegelpildile vastav, kuid mitteidentne, molekul.
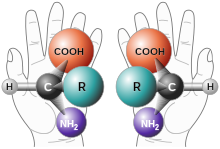
Kiraalne on mistahes objekt, kui selle peegeldust tasapinnalises peeglis ei saa viia kokkulangevusse lähtekujundiga – nii nagu meie parem ja vasak käsi või ühe paari kindad ei ole ühitatavad. Keemias tähendab see, et esinevad kaks mitteühildatavat stereoisomeerst molekuli.
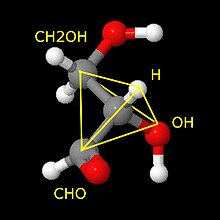
Enamusel kiraalsetel orgaanilistel molekulidel esineb nn kiraalsuskese, milles mingi aatomiga (tavaliselt süsinikuaatomiga) on seotud neli erinevat aatomit või aatomite rühma. Süsiniku aatom nelja erineva rühmaga (s.t. asümmeetriline süsinikuaatom) loob tüüpilise kiraalsustsentri, mistõttu saavad esineda käelised isomeerid, mille peegelpildid ei ühti. Selliseid peegelisomeere nimetatakse enantiomeerideks. Enantiomeeride 1:1 segu nimetatakse ratseemiliseks seguks. Asümmeetriliste isomeeride füüsikalised omadused ja keemilised omadused, kui reaktsioon toimub nn tavaliste mittekäeliste molekulidega, on identsed. Kuid oluliselt võib erineda nende toime teiste käeliste molekulidega, seega ka nende bioloogiline toime looduses valdavalt esinevate asümmeetriliste biomolekulidega. Siit tuleneb vajadus saada näiteks ravimeid nõutud käelisusega, sest "vasaku käe kinnas paremasse ei istu", s t vale käelisusega molekul ei toimi ja on kasutu või isegi kahjulik.
Keerulise struktuuriga molekulides esineb mitmeid kiraalseid tsentreid, mistõttu võimalike stereoisomeeride arv võib suureneda oluliselt. Näiteks kolesterooli molekulis on 8 kiraalset tsentrit ning võimalike stereoisomeeride arv on 256. Looduses esineb nendest ainult üks, mis on oluline ainevahetusprotsessis.
Pikad polümeersed molekulid nagu DNA, RNA, valkude jm bioloogilised molekulid on justkui kruvina spiraaliks (nimetatakse heeliks) keerdunud. Spiraale ei saa nende peegelpildiga ühitada.
Kui molekulis on kaks (või enam) kiraalkeset, on võimalik diastereoisomeeride moodustumine. Diastereomeerid on stereoisomeerid, mis pole enantiomeerid, s t ei ole teineteise peegelpildid. Erinevalt enantiomeeridest on diastereomeeride füüsikalised omadused erinevad, mistõttu on võimalik nende omavaheline lahutamine kristallisatsiooni, destillatsiooni või ekstraktsiooni meetoditega.
Molekulide kiraalsus ei piirdu vaid süsinikuaatomitega. Näiteks lämmastiku ja fosfori aatomid ning mõned metalliaatomid seotuna erinevate ligandidega moodustavad tetraeedrilist tüüpi kiraalse tsentri.
Kiraalsuse määramine muuda
Kiraalsete molekulide olemasolu meid huvitavas looduslikus või sünteesitud materjalis võib paljudel juhtudel kindlaks teha polariseeritud valguse pöördenurga mõõtmise teel või reaktsioonil teise kiraalse ühendiga. Välja on töötatud kiraalseid kolonne gaasi- ja vedelikukromatograafiale ning spetsiifilisi kapillaarelektroforeesi meetodeid. Need meetodid võimaldavad heal juhul enantiomeere eraldada ja määrata nende suhtelist sisaldust. Nimetatud meetodid ei võimalda aga määrata molekulide absoluutset konfiguratsiooni (asendajate tegelikku paigutust kiraalse tsentri ümber). Absoluutset konfiguratsiooni saab määrata röntgenstruktuuranalüüsil ja tuumamagnetresonantsspektroskoopia (TMR) abil.
Kirjandust muuda
Margus Lopp. Stereokeemia. Tallinna Tehnikaülikooli Kirjastus, 2014, 277 lk.
Vaata ka muuda
| Pildid, videod ja helifailid Commonsis: Kiraalsus |