Butüülrühm
Butüülrühm on molekuli osa (substituent) , mis koosneb üksiksidemetega seotud süsiniku ja vesiniku aatomitest ja kus on 4 süsiniku aatomit.




Kvantitatiivselt vastab butüülrühm butaani molekulile, milles puudub üks vesiniku aatom. Butüülrühma üldvalem on –C4H9, mille lühendina (sümbolina) kasutatakse –Bu. Butüülrühm ei ole reaalselt esinev aineosake, vaid formaalne vaba valentsiga rühm, millega molekulis on seotud veel mingi aatom või rühm.
Butüülrühma tähenduses on kasutatud ka terminit "butüülradikaal", mille põhitähendus on vaba radikaal Bu•, mis tähendab reaalset ebastabiilset intermediaati ja mitte formaalset molekuli osa, nagu seda on butüülrühm.
Nii nagu butaani molekulil esineb struktuuriisomeeria, nii esineb ka butüülrühmal neli isomeeri:
- normaalne butüül ehk n-butüül CH3-CH2-CH2-CH2– (süstemaatiline nimetus on butüül)
- sekundaarne butüül ehk sec-butüül CH3-CH2-CH(CH3)– (süstemaatiline nimetus on 1-metüülpropüül)
- isobutüül ehk i-butüül (CH3)2CH-CH2– (süstemaatiline nimetus on 2-metüülpropüül)
- tertsiaalne butüül ehk tert-butüül ehk t-butüül (CH3)3C– (süstemaatiline nimetus on 1,1-dimetüületüül)
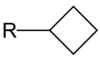
Tsüklobutüülrühm ehk c-butüülrühm vastab butüülrühma definitsioonile selles mõttes, et selles on 4 süsiniku aatomit, mis on ühendatud ainult üksiksidemetega, kuid need moodustavad tsüklilise struktuuri ning ühel süsiniku aatomil on C–H asemel C–R side (siin R on määratlemata aatom või aatomite kooslus, molekuli osa). Tsüklobutüülrühma valem ei ole –C4H9, vaid –C4H7. Mõnikord peetakse ka tsüklobutüüli butüülrühmaks.
Isomeeride teisesed nimetused näitavad seda, kui mitme süsiniku aatomiga on seotud see süsiniku aatom, mille juurest vesiniku aatom puudub: sec on lühend ingliskeelsest sõnast secondary, mis viitab arvule 2, ja tert on lühend ingliskeelsest sõnast tertiary, mis viitab arvule 3. n-täht n-butüüli nimes tähendab normaalset ja iso- tähendab hargnenud süsinikuahelat.
Tert-butüülrühm (ehk t-Bu) on ruumiliselt väga mahukas ja seetõttu mõjutab keemiliste reaktsioonide kiirust. Seda nimetatakse tert-butüüli efektiks. Tert-butüüli kasutataksegi keemiliste reaktsioonide stabiliseerimiseks. Samasuguste mõnevõrra nõrgemate omadustega on isobutüülrühm. Tert-butüüli efekti demonstreerib hästi Diels-Alderi reaktsioon, mis kulgeb tert-butüüliga üle 240 korra aeglasemalt kui vesinikuga.
Butüülrühma isomeerid ei ole ühesuguse keemilise aktiivsusega. Tert-butüüli elektronitihedus vaba sidemega aatomi juures on suurem kui sec-butüülil ja sellel omakorda suurem kui n-butüülil. Seetõttu on tert-butüüli aluselised omadused tugevamad kui sec-butüülil ja sellel omakorda suuremad kui n-butüülil. Niisugune keemilise aktiivsuse muutumine on näha ka reas tert-butanool, sec-butanool ja n-butanool.
Butüülliitium LiC4H9 on väga tugev metallorgaaniline alus ja võib reageerida väga nõrkade hapetega. Tänapäeval saab standardse reaktiivina osta butüülliitiumi kolme isomeeri: n-butüülliitiumi, sec-butüülliitiumi ja tert-butüülliitiumi.
Hüdrogeenimiseks kasutatava aine diisobutüülalumiiniumhüdriidi Al(C4H9)2OH koosseisus on kaks isobutüülrühma.