Telomeer
Telomeer (vanakreeka sõnadest τέλος (telos) 'lõpp' ja μέρος (merοs) 'osa') on DNA ahela piirkond enamiku liikide eukarüootse raku kromosoomi kummaski otsas.

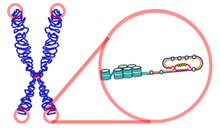
Telomeeri ülesanne on kaitsta kromosoomi otsi kahjustuse eest. Iga rakujagunemise käigus väheneb DNA ahela pikkus kromosoomi otstest just telomeeride piirkonnast, et kahjustada ei saaks geenid.
Telomeeride teine ülesanne on rakujagunemiste regulatsioon. Rakk on jagunemisvõimeline kuni telomeeride kriitilise pikkuseni; selle pikkuseni jõudes lakkab rakk jagunemast[1].
Telomeeride pikkus sõltub ka telomeraasi aktiivsusest. Telomeraasi RNA-komponent sisaldab telomeeri DNA-ga komplementaarset järjestust, mis toimib matriitsina telomeeri vastavate järjestuste sünteesimisel; nii saavad telomeerid tänu telomeraasile uueneda[1]. Telomeraasi aktiivsus eri tüüpi rakkudes võib olla väga erinev. Tavalisest suurem telomeraasi aktiivsus on seotud ka vähi tekke ja arenguga. Ligikaudu 90% kasvajates on telomeraas tavalisest aktiivsem[2].
Uurimislugu muuda
1970. aastate algul avastas vene teoreetik Aleksei Olovnikov, et kromosoomid ei saa oma otsi täielikult replitseerida. Tuginedes sellele ja Leonard Havflicki ideele somaatiliste rakkude piiratud jagunemise kohta, väitis Olovnikov, et DNA järjestused lähevad kaduma igal korral, kui DNA replitseerub. Protsess toimub seni, kuni kaotused jõuavad kriitilisele tasemele ja raku jagunemine peatub.[3][4]
Aastatel 1975–1977 töötas Elizabeth Blackburn Yale'i Ülikoolis koos Joseph Galliga. Koos avastasid nad tavapäratud lühikesed DNA järjestused kromosoomi otstes ehk telomeerid. Nende töö avaldati 1978. aastal. Telomeeride lühenemise mehhanism piirab tavaliselt jagunemiste arvu ja loomkatsetest võib järeldada, et see vastutab ka vananemise eest rakulisel tasandil.[5] Elizabeth Blackburn, Carol Greider ja Jack Szostak avastasid, kuidas telomeerid ja telomeraas kaitsevad kromosoome, ning said selle eest 2009. aastal Nobeli auhinna füsioloogia- ja meditsiinivaldkonnas.[6]
Telomeeri ja telomeraasi ehitus muuda
Telomeerid esinevad peaaegu kõigil eukarüootsetel rakkudel. Prokarüootidel selline struktuur puudub, sest erinevalt eukarüootidest on neil rõngaskromosoom. Telomeerid koosnevad kuni mitmest tuhandest lühikese korduva struktuuriga järjestusest. Inimese puhul on nendeks TTAGGG järjestused, mis on omavahel seotud spetsiifiliste valkudega.[2] Erinevatel organismidel on pisut erinevad järjestused. Näiteks on korduvaks järjestuseks putukatel TTAGG ja kõrgematel taimedel TTTAGGG. Guaniini (vastasahelas tsütosiini) on kordustes rikkalikult ja ühe korduse pikkus jääb enamjaolt vahemikku 6–8 aluspaari.[7] Ka telomeeride pikkus varieerub olulisel määral, alates ligikaudu 300 aluspaarist pärmil kuni mitme tuhande aluspaarini inimesel. Telomeersed otsad ei ole sugugi lineaarsed, vaid moodustavad keerukaid struktuure, mida nimetatakse telomeeri lingudeks ehk T-lingudeks [8]. Esmalt moodustub suur ring, mis on stabiliseeritud telomeeri seostusproteiinidega (TRF1) [9]. Telomeeri otsas olev üheahelalise DNA jupp on aga paardunud kaheahelalise telomeeri alaga, segades selle paardumist heeliksiks. Selle tulemusel tekib kolmeahelaline piirkond, mida nimetatakse T-linguks.[10]
Telomeraas on nukleoproteiin, mis inimesel sisaldab telomeraasi pöördtranskriptaasi aktiivsust (hTERT) ja telomeraas RNA-d (hTR). Pöördtranskriptaasid on sellised ensüümid, mis sünteesivad RNA-lt DNA-d. See on keskse molekulaarbioloogia dogma erand, sest tavaliselt sünteesitakse DNA-lt RNA ja RNA-lt omakorda valgud. hTR koosneb üheteistkümnest kordusega komplementaarsest aluspaarist ja käitub matriitsina pöördtranskriptaasile. Selle tulemusel lisatakse kromosoomi DNA 3´ otstele uusi kordusi.[2]
Ülesanded muuda
Telomeeride peamiseks ülesandeks on kompenseerida raku jagunemise käigus toimuvat kromosoomide lühenemist. DNA polümeraasi puuduste tõttu telomeeride pikkus väheneb replikatsiooni käigus 50–200 aluspaari.[2] Seega tänu telomeeridele ei lähe kaduma rakule olulisi geenijärjestusi, vaid eemaldub jupp kordusjärjestust, mis valke ei kodeeri. Telomeer on tänu telomeraassele aktiivsusele võimeline pikenema. Telomeerid somaatilistes rakkudes ei pikene aga lõpmatuseni ja see annab telomeeridele veel teise ülesande, milleks on rakujagunemiste kontroll. Rakk teeb läbi teatud hulga jagunemisi, mis on eri rakutüübiti erinev ja on määratud telomeeride pikkusega. Mida pikem on telomeer, seda rohkem jagunemisi rakk saab läbi viia. Teatud punkti jõudes, kui telomeerid on lühenenud, jagunemine peatub ja rakk siseneb püsivasse kasvuaresti ehk vananemisfaasi.[2] Seega on ka vananemine reguleeritud telomeeridega. Kui aga mingi mutatsiooni mõjul ei lõpeta rakk jagunemist ja telomeerid muutuvad kriitiliselt lühikeseks, tekib kromosomaalse ebastabiilsus ning algab apoptoos ehk programmeeritud rakusurm.[2] Rakkudel, mis kogu organismi elu vältel paljunema peavad, on aktiivne telomeraas. Sellised rakud on näiteks idurakud ja vereloome tüvirakud. Enamikus somaatilistes rakkudes on telomeraas represseeritud ja see põhjustab rakkude piiratud jagunemisvõimet.[8]
Telomeerid on vajalikud ka selleks, et rakkude jagunemist ei peatataks liiga vara. Nimelt toimib rakus kontrollsüsteem, mis tuvastades DNA lahtise otsa või katke, peatab rakujagunemise. Selline kontrollsüsteem on üldiselt vajalik vältimaks paljude mutatsioonide edasikandumist. Telomeerid katavad kromosoomi otsi nii, et kontrollsüsteem ei tuvasta neid DNA katketena.[7] Telomeerid kaitsevad kromosoome ka tuumas olevate ensüümide lagundava toime eest. Samas on takistatud ka kromosoomide omavaheline kokkujäämine.
Telomeerid ja vähk muuda
Seda, et telomeerid on seotud vähiga, pakuti välja juba 1990. aastal. 1994. aastal õnnestuski Christopher M. Counteril, Silvia Bacchettil, Calvin B. Harleyl koos kolleegidega McMasteri Ülikoolist näidata, et telomeraas on aktiivne vähkkasvaja rakkudes [11].
Juhul kui rakutsükli kontrollpunktid ei toimi korrektselt, võib rakk läbida rakujagunemise peatumise faasi ja jätkata jagunemist. Sellised rakud lähevad faasi, mida nimetatakse kriisiks. Kriisis on telomeerid lühenenud, aga rakud püüavad endiselt jaguneda. Selles faasis on rakkude jagunemine ja suremine tasakaalus. Lühenenud telomeeridega rakkude kromosoomid muutuvad ebastabiilseks. Mitmed kromosomaalsed ümberkorraldused hakkavad toimuma. Sellised suured muutused võivad viia kasvaja supressormehhanismide kaoni, apoptoosist hoidumiseni ja ka telomeraasi uuesti aktiivseks muutumiseni. Kui telomeraas on taasaktiveeritud või rohkem aktiivne, siis see võib viia rakkude seas erinevate tulemusteni. Esiteks, kui telomeraasi ei produtseerita piisavalt, siis pole need rakud võimeliselt pikaajaliselt jagunema ja suurt pahaloomuliste vähirakkude hulka ei moodustu. Teiseks, telomeraasi toodetakse liias, sel juhul telomeerid pikenevad kiiresti. Selliseid olukordi tekib reaalses elus aga suhteliselt harva, seda esineb vähem kui 10% vähkidel. Kõige sagedasem on olukord, kus telomeeride pikkus vähirakkudes on sama või väiksem kui vastava normaalse koe rakkudes. Sel juhul areneb pahaloomuline kasvaja.[8]
Telomeraasi on leitud ligikaudu 90% kasvajarakkudes ja see on sageli ka 10–20 korda aktiivsem kui tavalistes rakkudes [8]. Telomeraasi abil saavutavad rakud surematuse. Kui rakud paljunevad kontrollimatult, võivad need tungida lähedastesse kudedesse ja neid kahjustada. Mõned kasvajarakud võivad kehas liikuda uutesse piirkondadesse ja algatada uute kasvajate arengu.
Teraapiad muuda
Kuna telomeraas ei ole aktiivne enamikus tavalistes inimese rakkudes, siis püüavad mitmed teadlased üle kogu maailma välja töötada telomeraasi abil toimivat vähiteraapiat. Proovitakse eri viisidel inhibeerida telomeraasi. Mitu strateegiat, mis on suunatud kas telomeraasi RNA komponendi (hTR) või katalüütilise ühiku (TERT) vastu, on praegu jõudnud kliiniliste katsete faasi. hTR-le suunatud ravi toimub antisense oligonukleotiidide ja ribosüümide abil. Antisense oligonukleotiidid on komplementaarsed osaga hTR-ist ja seetõttu oligonukleotiid paardub hTR-ga. See takistab telomeraasi seondumist telomeerile või hoopis algatab RNA lagundamise. Ka ribosüüm seondub komplementaarsuse alusel ja lagundab RNA-d. hTERT-i inhibeerimiseks kasutatakse erinevaid pöördtranskriptaasi inhibiitoreid, näiteks BIBR1532, mis on sünteetiline molekul, kuid inhibeerivaid komponente on leitud ka puuvõrgus ja rohelises tees.[8]
Viited muuda
- ↑ 1,0 1,1 Lauren Pecorino. (2008). Molecular Biology of Cancer: Mechanisms, Targets, and Therapeutics, 3. trükk, Oxford University Press 2012, ISBN 9780199577170, lk 67.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Pecorino, L. (2008). Molecular Biology of Cancer. Oxford University Press. ISBN 978-0-19-921148-7
- ↑ Оловников А. М. Принцип маргинотомии в матричном синтезе полинуклеотидов. – Доклады АН СССР, 1971, kd 201, nr 6, lk 1496–1499.
- ↑ Olovnikov AM (September 1973). "A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon". J. Theor. Biol. 41 (1): 181–90. doi:10.1016/0022-5193(73)90198-7. PMID 4754905.
- ↑ Harrison's Principles of Internal Medicine, Ch. 69, Cancer cell biology and angioge
- ↑ "The 2009 Nobel Prize in Physiology or Medicine – Press Release". Nobelprize.org. 2009-10-05. Retrieved 2012-06-12
- ↑ 7,0 7,1 Rakubioloogia avalikud õppematerjalid
- ↑ 8,0 8,1 8,2 8,3 8,4 Shay, J.W. ja Wright, W.E. (2011) Role of telomeres and telomerase in cancer. Semin Cancer Biol.
- ↑ Griffith J, Comeau L, Rosenfield S, Stansel R, Bianchi A, Moss H, de Lange T (1999). "Mammalian telomeres end in a large duplex loop". Cell 97 (4): 503–14
- ↑ urge S, Parkinson G, Hazel P, Todd A, Neidle S (2006). "Quadruplex DNA: sequence, topology and structure". Nucleic Acids Res 34 (19): 5402–15
- ↑ "Greider, C. W. ja Blackburn, E. H. Telomeres, Telomerase and Cancer. Scientific American". Originaali arhiivikoopia seisuga 25. detsember 2012. Vaadatud 2. oktoobril 2012.
Kirjandus muuda
- Maimets, T. (1999). Molekulaarne rakubioloogia. Ilmamaa. ISBN 9985-878-65-5
Välislingid muuda
| Pildid, videod ja helifailid Commonsis: Telomeer |
- Rakubioloogia avalikud õppematerjalid
- Ülo Maiväli: Telomeerid ja surelikkuse bioloogia Horisont, 6/2009
- Tiit Kändler, Rakkude kaitsjad võivad väljendada elu pikkust Eesti Päevaleht, 8.12.2011
- Telomeres and Telomerase: The Means to the End Elizabeth Blackburni ingliskeelne loeng.